Osmotische druk en toniciteit
 Share
Share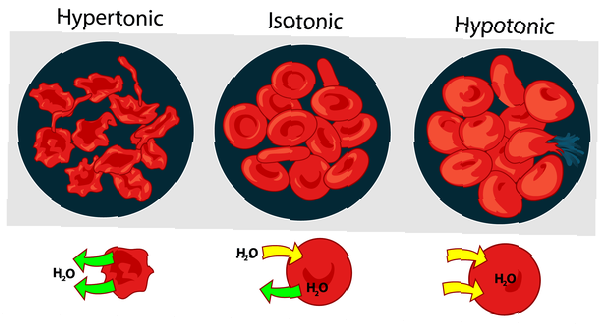
Osmotische druk en toniciteit zijn vaak verwarrend voor mensen. Beide zijn wetenschappelijke termen die betrekking hebben op druk. Osmotische druk is de druk van een oplossing tegen een semipermeabel membraan om te voorkomen dat water naar binnen stroomt over het membraan. Tonicity is de maat voor deze druk. Als de concentratie opgeloste stoffen aan beide zijden van het membraan gelijk is, dan is er geen neiging voor water om over het membraan te bewegen en geen osmotische druk. De oplossingen zijn isotoon ten opzichte van elkaar. Gewoonlijk is er een hogere concentratie opgeloste stoffen aan de ene kant van het membraan dan de andere. Als je onduidelijk bent over osmotische druk en toniciteit, kan het zijn omdat je in de war bent over hoe het verschil tussen diffusie en osmose.
Diffusie versus osmose
Diffusie is de beweging van deeltjes van een gebied met een hogere concentratie naar een gebied met een lagere concentratie. Als u bijvoorbeeld suiker aan water toevoegt, diffundeert de suiker door het water totdat de concentratie suiker in het water constant is in de oplossing. Een ander voorbeeld van diffusie is hoe de geur van parfum zich door een kamer verspreidt.
Tijdens osmose is er, net als bij diffusie, de neiging van deeltjes om dezelfde concentratie in de oplossing te zoeken. De deeltjes kunnen echter te groot zijn om een semipermeabele membraanscheidingsgebieden van een oplossing te passeren, zodat water over het membraan beweegt. Als u een suikeroplossing hebt aan de ene kant van een semipermeabel membraan en zuiver water aan de andere kant van het membraan, zal er altijd druk zijn aan de waterzijde van het membraan om te proberen de suikeroplossing te verdunnen. Betekent dit dat al het water in de suikeroplossing stroomt? Waarschijnlijk niet, omdat de vloeistof mogelijk druk op het membraan uitoefent en de druk gelijk maakt.
Als u bijvoorbeeld een cel in zoet water plaatst, stroomt het water in de cel, waardoor deze opzwelt. Zal al het water in de cel stromen? Nee. De cel zal scheuren of anders zal deze opzwellen tot een punt waarop de druk op het membraan groter is dan de druk van het water dat de cel probeert binnen te dringen.
Natuurlijk kunnen kleine ionen en moleculen een semipermeabel membraan kruisen, dus opgeloste stoffen zoals kleine ionen (Na+, cl-) zich gedragen zoals ze zouden doen als eenvoudige diffusie zou optreden.
Hypertoniciteit, isotoniciteit en hypotoniciteit
De toniciteit van oplossingen ten opzichte van elkaar kan worden uitgedrukt als hypertoon, isotoon of hypotoon. Het effect van verschillende externe opgeloste stofconcentraties op rode bloedcellen is een goed voorbeeld voor een hypertone, isotone en hypotone oplossing.
Hypertonische oplossing of hypertoniciteit
Wanneer de osmotische druk van de oplossing buiten de bloedcellen hoger is dan de osmotische druk in de rode bloedcellen, is de oplossing hypertoon. Het water in de bloedcellen verlaat de cellen in een poging de osmotische druk te egaliseren, waardoor de cellen krimpen of ontstaan.
Isotone oplossing of isotoniciteit
Wanneer de osmotische druk buiten de rode bloedcellen dezelfde is als de druk in de cellen, is de oplossing isotoon met betrekking tot het cytoplasma. Dit is de gebruikelijke toestand van rode bloedcellen in plasma.
Hypotone oplossing of hypotoniciteit
Wanneer de oplossing buiten de rode bloedcellen een lagere osmotische druk heeft dan het cytoplasma van de rode bloedcellen, is de oplossing hypotoon ten opzichte van de cellen. De cellen nemen water op in een poging om de osmotische druk te vereffenen, waardoor ze opzwellen en mogelijk barsten.
