Osmose Definitie in Chemie
 Share
Share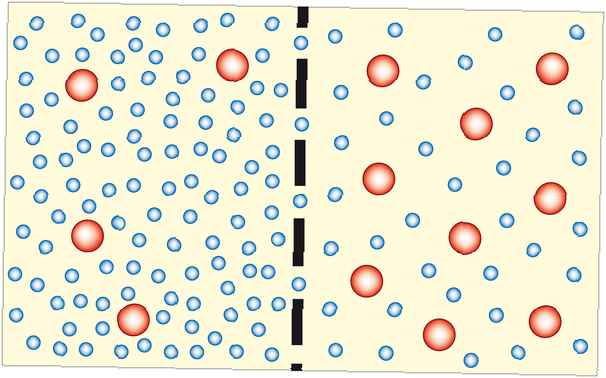
Twee belangrijke massatransportprocessen in chemie en biologie zijn diffusie en osmose.
Definitie van osmose
Osmose is het proces waarbij oplosmiddelmoleculen door een semipermeabel membraan bewegen van een verdunde oplossing naar een meer geconcentreerde oplossing (die meer verdund wordt). In de meeste gevallen is het oplosmiddel water. Het oplosmiddel kan echter een andere vloeistof of zelfs een gas zijn. Osmose kan worden gemaakt om werk te doen.
Geschiedenis
Het fenomeen osmose was het eerste document in 1748 door Jean-Antoine Nollet. De term 'osmose' is bedacht door de Franse arts René Joachim Henri Dutrochet, die deze heeft afgeleid van de termen 'endosmose' en 'exosmose'.
Hoe osmose werkt
Osmose werkt om de concentratie aan beide zijden van een membraan gelijk te maken. Omdat de opgeloste deeltjes niet in staat zijn om het membraan te passeren, is het het water (of een ander oplosmiddel) dat moet bewegen. Hoe dichter het systeem bij evenwicht komt, hoe stabieler het wordt, dus osmose is thermodynamisch gunstig.
Voorbeeld van osmose
Een goed voorbeeld van osmose wordt gezien wanneer rode bloedcellen in zoet water worden geplaatst. Het celmembraan van de rode bloedcellen is een semipermeabel membraan. De concentratie ionen en andere opgeloste moleculen is hoger in de cel dan daarbuiten, dus water beweegt via osmose de cel in. Hierdoor zwellen de cellen op. Omdat de concentratie geen evenwicht kan bereiken, wordt de hoeveelheid water die in de cel kan bewegen gemodereerd door de druk van het celmembraan die op de inhoud van de cel werkt. Vaak neemt de cel meer water op dan het membraan kan verdragen, waardoor de cel barst.
Een verwante term is osmotische druk. Osmotische druk is de externe druk die zodanig moet worden toegepast dat er geen netto beweging van oplosmiddel over een membraan zou zijn.
