Wat zijn zuren en basen?
 Share
Share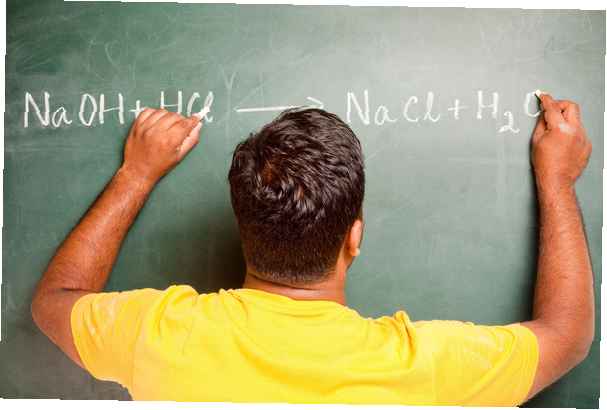
Er zijn verschillende methoden om zuren en basen te definiëren. Hoewel deze definities elkaar niet tegenspreken, verschillen ze wel in hoe inclusief ze zijn. De meest gebruikelijke definities van zuren en basen zijn Arrhenius-zuren en -basen, Brønsted-Lowry-zuren en -basen en Lewis-zuren en -basen. Antoine Lavoisier, Humphry Davy en Justus Liebig hebben ook opmerkingen gemaakt over zuren en basen, maar hebben geen definities geformaliseerd.
Svante Arrhenius-zuren en basen
De Arrhenius-theorie van zuren en basen dateert uit 1884, voortbouwend op zijn observatie dat zouten, zoals natriumchloride, dissociëren in wat hij noemde ionen wanneer geplaatst in water.
- zuren produceren H+ ionen in waterige oplossingen
- basen produceren OH- ionen in waterige oplossingen
- water vereist, dus laat alleen waterige oplossingen toe
- alleen protische zuren zijn toegestaan; vereist om waterstofionen te produceren
- alleen hydroxidebasen zijn toegestaan
Johannes Nicolaus Brønsted - Thomas Martin Lowry-zuren en basen
De theorie van Brønsted of Brønsted-Lowry beschrijft zuur-base reacties als een zuur dat een proton afgeeft en een base die een proton accepteert. Hoewel de definitie van zuur vrijwel hetzelfde is als die voorgesteld door Arrhenius (een waterstofion is een proton), is de definitie van wat een base vormt veel breder.
- zuren zijn protondonoren
- basen zijn protonacceptoren
- waterige oplossingen zijn toegestaan
- basen naast hydroxiden zijn toegestaan
- alleen protische zuren zijn toegestaan
Gilbert Newton Lewis-zuren en basen
De Lewis-theorie van zuren en basen is het minst beperkende model. Het gaat helemaal niet over protonen, maar gaat uitsluitend over elektronenparen.
- zuren zijn elektronenpaaracceptoren
- bases zijn elektronenpaardonoren
- minst beperkende van de zuur-base definities
Eigenschappen van zuren en basen
Robert Boyle beschreef de eigenschappen van zuren en basen in 1661. Deze eigenschappen kunnen worden gebruikt om gemakkelijk onderscheid te maken tussen de twee chemische producten zonder ingewikkelde tests:
zuren
- smaak zuur (proef ze niet!) - het woord 'zuur' komt uit het Latijn acere, wat 'zuur' betekent
- zuren zijn bijtend
- zuren veranderen lakmoes (een blauwe plantaardige kleurstof) van blauw naar rood
- hun waterige (water) oplossingen geleiden elektrische stroom (zijn elektrolyten)
- reageren met basen om zouten en water te vormen
- waterstofgas ontwikkelen (H2) bij reactie met een actief metaal (zoals alkalimetalen, aardalkalimetalen, zink, aluminium)
Gemeenschappelijke Zuren
- citroenzuur (van bepaalde soorten fruit en groenten, met name citrusvruchten)
- ascorbinezuur (vitamine C, vanaf bepaalde soorten fruit)
- azijn (5% azijnzuur)
- koolzuur (voor carbonatatie van frisdranken)
- melkzuur (in karnemelk)
bases
- smaak bitter (proef ze niet!)
- voel glad of zeepachtig (raak ze niet willekeurig aan!)
- basen veranderen de kleur van lakmoes niet; ze kunnen rode (verzuurde) lakmoes weer blauw maken
- hun waterige (water) oplossingen geleiden een elektrische stroom (zijn elektrolyten)
- reageren met zuren om zouten en water te vormen
Common Bases
- wasmiddelen
- zeep
- loog (NaOH)
- huishoudelijke ammoniak (waterig)
Sterke en zwakke zuren en basen
De sterkte van zuren en basen hangt af van hun vermogen om te dissociëren of in hun ionen in water te breken. Een sterk zuur of sterke base dissocieert volledig (bijvoorbeeld HC1 of NaOH), terwijl een zwak zuur of zwakke base slechts gedeeltelijk dissocieert (bijvoorbeeld azijnzuur).
De zuurdissociatieconstante en base-dissociatieconstante geven de relatieve sterkte van een zuur of base aan. De zure dissociatieconstante Keen is de evenwichtsconstante van een zuur-base dissociatie:
HA + H2O ⇆ A- + H3O+
waarbij HA het zuur is en A- is de geconjugeerde base.
Keen = [A-] [H3O+] / [HA] [H2O]
Dit wordt gebruikt om pK te berekeneneen, de logaritmische constante:
pkeen = - logboek10 Keen
Hoe groter de pKeen waarde, hoe kleiner de dissociatie van het zuur en hoe zwakker het zuur. Sterke zuren hebben een pKeen van minder dan -2.
