Definitie en voorbeelden van toeschouwersionen
 Share
Share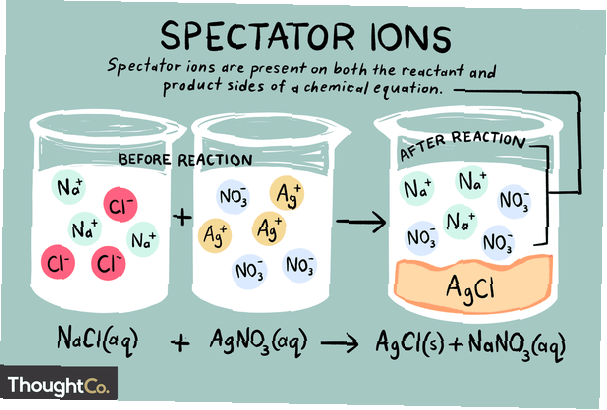
Ionen zijn atomen of moleculen die een netto elektrische lading dragen. Er zijn verschillende soorten ionen, waaronder kationen, anionen en toeschouwerionen. Een toeschouwerion is er een dat in dezelfde vorm voorkomt aan zowel de reactant- als productzijde van een chemische reactie.
Spectator Ion Definitie
Toeschouwerionen kunnen kationen (positief geladen ionen) of anionen (negatief geladen ionen) zijn. Het ion is ongewijzigd aan beide zijden van een chemische vergelijking en heeft geen invloed op het evenwicht. Bij het schrijven van een netto ionische vergelijking, worden toeschouwerionen in de oorspronkelijke vergelijking genegeerd. Dus de totaal ionische reactie is anders dan de netto chemische reactie.
Voorbeelden van toeschouwersionen
Overweeg de reactie tussen natriumchloride (NaCl) en kopersulfaat (CuSO4) in waterige oplossing.
2 NaCl (aq) + CuSO4 (aq) → 2 Na+ (aq) + SO42- (aq) + CuCl2 (S)
De ionische vorm van deze reactie is: 2 Na+ (aq) + 2 Cl- (aq) + Cu2+ (aq) + SO42- (aq) → 2 Na+ (aq) + SO42- (aq) + CuCl2 (S)
De natriumionen en sulfaationen zijn de toeschouwerionen in deze reactie. Ze verschijnen onveranderd in zowel de product- als de reactantzijde van de vergelijking. Deze ionen "kijken" alleen maar (kijken) terwijl de andere ionen het koperchloride vormen. De toeschouwerionen worden geannuleerd uit een reactie bij het schrijven van de netto ionische vergelijking, dus de netto ionische vergelijking voor dit voorbeeld zou zijn:
2 Cl- (aq) + Cu2+ (aq) → CuCl2 (S)
Hoewel toeschouwerionen in de netto-reactie worden genegeerd, beïnvloeden ze de Debye-lengte.
Table of Common Spectator Ions
Deze ionen zijn toeschouwerionen omdat ze niet met water reageren, dus wanneer oplosbare verbindingen van deze ionen in water oplossen, hebben ze geen directe invloed op de pH en kunnen ze worden genegeerd. Hoewel je een tabel kunt raadplegen, is het de moeite waard om de gemeenschappelijke toeschouwerionen uit het hoofd te leren, omdat het kennen van hen het gemakkelijker maakt om sterke zuren, sterke basen en neutrale zouten in een chemische reactie te identificeren. De eenvoudigste manier om ze te leren is in groepen van drie of trio's van ionen die samen op het periodiek systeem der elementen worden gevonden.
