Periodiek systeem der elementen Thoriumfeiten
 Share
Share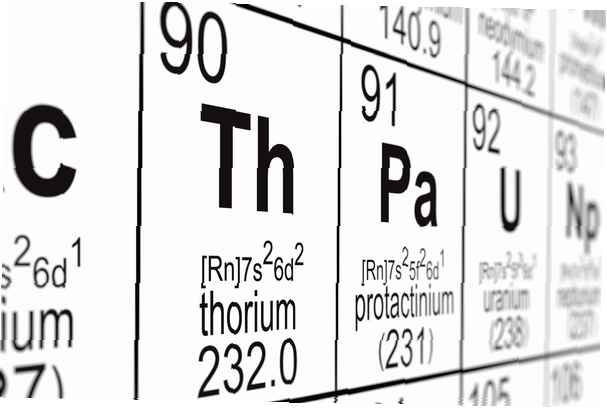
Atoomnummer: 90
Symbool: th
Atoomgewicht: 232.0381
Ontdekking: Jons Jacob Berzelius 1828 (Zweden)
Elektronen configuratie: [Rn] 6d2 7s2
Woord oorsprong: Genoemd naar Thor, de Noorse god van oorlog en donder
isotopen: Alle isotopen van thorium zijn onstabiel. De atoommassa's variëren van 223 tot 234. Th-232 komt van nature voor, met een halfwaardetijd van 1,41 x 1010 jaar. Het is een alpha-emitter die zes alfa- en vier beta-vervalstappen doorloopt om de stabiele isotoop Pb-208 te worden.
Eigendommen: Thorium heeft een smeltpunt van 1750 ° C, kookpunt ~ 4790 ° C, soortelijk gewicht van 11,72, met een valentie van +4 en soms +2 of +3. Zuiver thoriummetaal is een luchtstabiel zilverachtig wit dat maandenlang zijn glans kan behouden. Zuivere thorium is zacht, zeer ductiel en kan worden getrokken, gestuikt en koudgewalst. Thorium is dimorf en gaat van een kubische structuur naar een lichaamsgerichte kubische structuur bij 1400 ° C. Het smeltpunt van thoriumoxide is 3300 ° C, wat het hoogste smeltpunt van de oxiden is. Thorium wordt langzaam aangevallen door water. Het lost niet gemakkelijk op in de meeste zuren, behalve zoutzuur. Thorium verontreinigd door zijn oxide zal langzaam grijs worden en uiteindelijk zwart worden. De fysische eigenschappen van het metaal zijn sterk afhankelijk van de hoeveelheid oxide die aanwezig is. Poeder in thorium is pyrofoor en moet met zorg worden behandeld. Door thoriumdraaien in lucht te verwarmen, zullen ze ontbranden en branden met een schitterend wit licht. Thorium valt uiteen om radongas, een alfa-emitter en stralingsgevaar te produceren, dus gebieden waar thorium wordt opgeslagen of gehanteerd, vereisen goede ventilatie.
Toepassingen: Thorium wordt gebruikt als een kernenergiebron. De inwendige hitte van de aarde wordt grotendeels toegeschreven aan de aanwezigheid van thorium en uranium. Thorium wordt ook gebruikt voor draagbare gaslampen. Thorium is gelegeerd met magnesium om kruipweerstand en hoge sterkte bij verhoogde temperaturen te verlenen. De lage werkfunctie en hoge elektronenemissie maken thorium nuttig voor het coaten van wolfraamdraad dat wordt gebruikt in elektronische apparatuur. Het oxide wordt gebruikt om laboratoriumkroezen en glas te maken met een lage dispersie en hoge brekingsindex. Het oxide wordt ook gebruikt als katalysator bij het omzetten van ammoniak in salpeterzuur, bij de productie van zwavelzuur en bij het kraken van aardolie.
bronnen: Thorium wordt gevonden in thorite (ThSiO4) en thorianiet (ThO2 + UO2). Thorium kan worden gewonnen uit monzoniet, dat 3-9% ThO bevat2 geassocieerd met andere zeldzame aarden. Thoriummetaal kan worden verkregen door thoriumoxide te verminderen met calcium, door reductie van thoriumtetrachloride met een alkalimetaal, door elektrolyse van watervrij thoriumchloride in een gesmolten mengsel van kalium en natriumchloriden, of door reductie van thoriumtetrachloride met watervrij zinkchloride.
Elementclassificatie: Radioactieve zeldzame aarde (Actinide)
Thorium fysieke gegevens
Dichtheid (g / cc): 11.78
Smeltpunt (K): 2028
Kookpunt (K): 5060
Uiterlijk: grijs, zacht, kneedbaar, ductiel, radioactief metaal
Atoomstraal (pm): 180
