Valence Bond (VB) Theorie Definitie
 Share
Share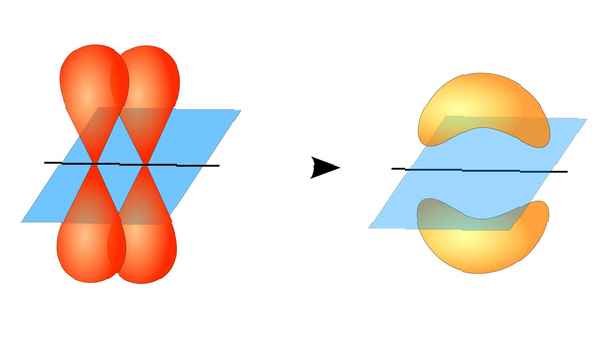
Valence bond (VB) theorie is een chemische bindingstheorie die de chemische binding tussen twee atomen verklaart. Net als de moleculaire orbitale (MO) theorie verklaart het binding met behulp van kwantummechanica. Volgens de valentiebindingstheorie wordt binding veroorzaakt door de overlapping van halfgevulde atomaire orbitalen. De twee atomen delen elkaars ongepaarde elektron om een gevulde orbitaal te vormen om een hybride orbitaal te vormen en aan elkaar te binden. Sigma- en Pi-obligaties maken deel uit van de theorie van valentiebanden.
Key Takeaways: Valence Bond (VB) Theory
- Valence bond theory of VB theory is een theorie gebaseerd op de kwantummechanica die verklaart hoe chemische binding werkt.
- In de valentiebindingstheorie worden de atoomorbitalen van individuele atomen gecombineerd om chemische bindingen te vormen.
- De andere belangrijke theorie van chemische binding is moleculaire orbitale theorie of MO-theorie.
- Valence-bindtheorie wordt gebruikt om uit te leggen hoe covalente chemische bindingen zich tussen verschillende moleculen vormen.
Theorie
Valence-bindingstheorie voorspelt covalente bindingvorming tussen atomen wanneer ze halfgevulde atomaire orbitalen hebben, die elk een enkel ongepaard elektron bevatten. Deze atomaire orbitalen overlappen elkaar, dus elektronen hebben de grootste kans om zich binnen het bindingsgebied te bevinden. Beide atomen delen dan de enkele ongepaarde elektronen om zwak gekoppelde orbitalen te vormen.
De twee atomaire orbitalen hoeven niet hetzelfde te zijn als elkaar. Sigma- en pi-obligaties kunnen bijvoorbeeld overlappen. Sigmabindingen ontstaan wanneer de twee gedeelde elektronen orbitalen hebben die elkaar onderling overlappen. Pi-bindingen vormen zich daarentegen wanneer de orbitalen elkaar overlappen, maar evenwijdig aan elkaar zijn.
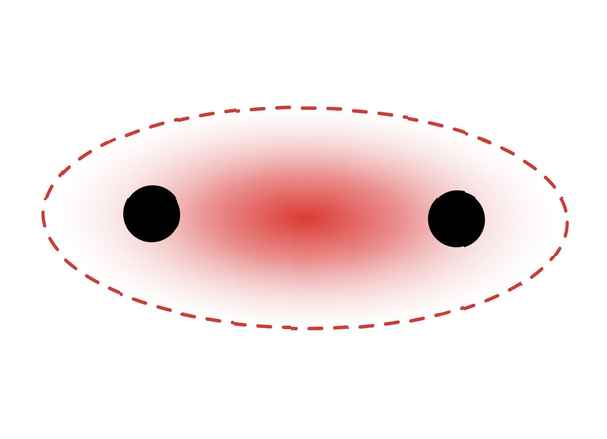 Dit diagram geeft een sigma-binding tussen twee atomen weer. Het rode gebied vertegenwoordigt gelokaliseerde elektronendichtheid. ZooFari / Creative Commons Naamsvermelding-Gelijk delen 3.0 Unported-licentie
Dit diagram geeft een sigma-binding tussen twee atomen weer. Het rode gebied vertegenwoordigt gelokaliseerde elektronendichtheid. ZooFari / Creative Commons Naamsvermelding-Gelijk delen 3.0 Unported-licentie Sigmabindingen vormen zich tussen elektronen van twee s-orbitalen omdat de orbitale vorm bolvormig is. Enkele bindingen bevatten één sigma-binding. Dubbele bindingen bevatten een sigma-binding en een pi-binding. Drievoudige obligaties bevatten een sigma-obligatie en twee pi-obligaties. Wanneer chemische bindingen tussen atomen worden gevormd, kunnen de atomaire orbitalen hybriden van sigma- en pi-bindingen zijn.
De theorie helpt om de vorming van banden te verklaren in gevallen waarin een Lewis-structuur echt gedrag niet kan beschrijven. In dit geval kunnen verschillende valentiebindingsstructuren worden gebruikt om een enkele Lewis-strictuur te beschrijven.
Geschiedenis
De theorie van de valentiebinding is gebaseerd op Lewis-structuren. G.N. Lewis stelde deze structuren in 1916 voor, gebaseerd op het idee dat twee gedeelde bindingselektronen chemische bindingen vormden. Kwantummechanica werd toegepast om bindingseigenschappen te beschrijven in de Heitler-London-theorie van 1927. Deze theorie beschrijft de chemische bindingvorming tussen waterstofatomen in het H2-molecuul met behulp van de golfvergelijking van Schrödinger om de golffuncties van de twee waterstofatomen samen te voegen. In 1928 combineerde Linus Pauling het idee van Lewis-paarbinding met de Heitler-London-theorie om de theorie van valentiebinding voor te stellen. Valence Bond-theorie is ontwikkeld om resonantie en orbitale hybridisatie te beschrijven. In 1931 publiceerde Pauling een artikel over de theorie van valentiebanden, getiteld "On the Nature of the Chemical Bond." De eerste computerprogramma's die werden gebruikt om chemische binding te beschrijven, gebruikten moleculaire orbitale theorie, maar sinds de jaren 1980 zijn principes van valentiebindingstheorie programmeerbaar geworden. Tegenwoordig concurreren de moderne versies van deze theorieën met elkaar in termen van het nauwkeurig beschrijven van echt gedrag.
Toepassingen
Valence-obligatietheorie kan vaak verklaren hoe covalente obligaties worden gevormd. Het diatomische fluormolecuul, F2, is een voorbeeld. Fluoratomen vormen afzonderlijke covalente bindingen met elkaar. De F-F binding ontstaat door overlapping pz orbitalen, die elk een enkel ongepaard elektron bevatten. Een vergelijkbare situatie doet zich voor in waterstof, H2, maar de verbindingslengten en sterkte zijn verschillend tussen H2 en F2 moleculen. Er vormt zich een covalente binding tussen waterstof en fluor in waterstoffluoride, HF. Deze binding ontstaat uit de overlap van waterstof 1s orbitaal en het fluor 2pz orbitaal, die elk een niet-gekoppeld elektron hebben. In HF delen zowel de waterstof- als de fluoratomen deze elektronen in een covalente binding.
bronnen
- Cooper, David L .; Gerratt, Joseph; Raimondi, Mario (1986). "De elektronische structuur van het benzeenmolecuul." Natuur. 323 (6090): 699. doi: 10.1038 / 323699a0
- Messmer, Richard P .; Schultz, Peter A. (1987). "De elektronische structuur van het benzeenmolecuul." Natuur. 329 (6139): 492. doi: 10.1038 / 329492a0
- Murrell, J.N .; Kettle, S.F.A .; Tedder, J.M. (1985). De chemische binding (2e editie). John Wiley & Sons. ISBN 0-471-90759-6.
- Pauling, Linus (1987). "Elektronische structuur van het benzeenmolecuul." Natuur. 325 (6103): 396. doi: 10.1038 / 325396d0
- Shaik, Sason S .; Phillipe C. Hiberty (2008). Een scheikundige gids voor Valence Bond-theorie. New Jersey: Wiley-Interscience. ISBN 978-0-470-03735-5.
