Soorten chemische reacties
 Share
Share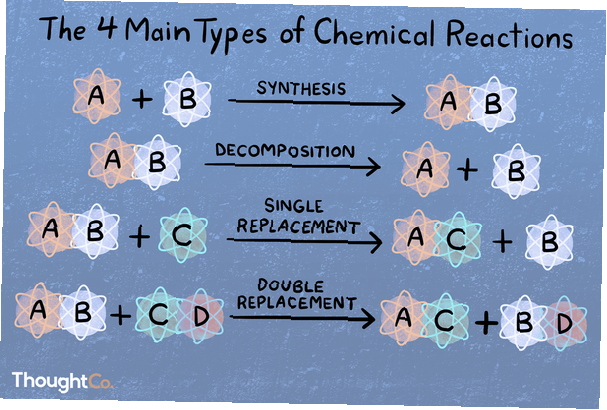
Een chemische reactie is een proces dat in het algemeen wordt gekenmerkt door een chemische verandering waarbij de uitgangsmaterialen (reactanten) verschillen van de producten. Chemische reacties hebben de neiging om de beweging van elektronen te betrekken, wat leidt tot de vorming en verbreking van chemische bindingen. Er zijn verschillende soorten chemische reacties en meer dan één manier om ze te classificeren. Hier zijn enkele veel voorkomende reactietypen:
Oxidatie-reductie of redoxreactie
In een redoxreactie worden de oxidatiegetallen van atomen veranderd. Redoxreacties kunnen de overdracht van elektronen tussen chemische soorten inhouden.
De reactie die optreedt wanneer ik2 is gereduceerd tot I- en S2O32- (thiosulfaatanion) wordt geoxideerd tot S4O62- geeft een voorbeeld van een redoxreactie:
2 S2O32-(aq) + I2(aq) → S4O62-(aq) + 2 I-(Aq)
Directe combinatie of synthesereactie
In een synthesereactie combineren twee of meer chemische soorten om een complexer product te vormen.
A + B → AB
De combinatie van ijzer en zwavel om ijzer (II) sulfide te vormen is een voorbeeld van een synthesereactie:
8 Fe + S8 → 8 FeS
Chemische ontleding of analyse Reactie
Bij een ontledingsreactie wordt een verbinding opgedeeld in kleinere chemische soorten.
AB → A + B
De elektrolyse van water tot zuurstof en waterstofgas is een voorbeeld van een ontledingsreactie:
2 H2O → 2 H2 + O2
Enkele verplaatsing of vervangingsreactie
Een substitutie of enkele verplaatsingsreactie wordt gekenmerkt doordat een element door een ander element uit een verbinding wordt verplaatst.
A + BC → AC + B
Een voorbeeld van een substitutiereactie treedt op wanneer zink wordt gecombineerd met zoutzuur. Het zink vervangt de waterstof:
Zn + 2 HCl → ZnCl2 + H2
Metathese of dubbele verplaatsingsreactie
In een dubbele verplaatsings- of metathesereactie wisselen twee verbindingen bindingen of ionen uit om verschillende verbindingen te vormen.
AB + CD → AD + CB
Een voorbeeld van een dubbele verplaatsingsreactie treedt op tussen natriumchloride en zilvernitraat om natriumnitraat en zilverchloride te vormen.
NaCl (aq) + AgNO3(aq) → NaNO3(aq) + AgCl (s)
Zuur-base reactie
Een zuur-base reactie is een type dubbele verplaatsingsreactie die optreedt tussen een zuur en een base. De H+ ion in het zuur reageert met de OH- ion in de basis om water en een ionisch zout te vormen:
HA + BOH → H2O + BA
De reactie tussen waterstofbromide (HBr) en natriumhydroxide is een voorbeeld van een zuur-base reactie:
HBr + NaOH → NaBr + H2O
Verbranding
Een verbrandingsreactie is een type redoxreactie waarbij een brandbaar materiaal wordt gecombineerd met een oxidatiemiddel om geoxideerde producten te vormen en warmte te genereren (exotherme reactie). Gewoonlijk combineert zuurstof in een verbrandingsreactie met een andere verbinding om kooldioxide en water te vormen. Een voorbeeld van een verbrandingsreactie is het verbranden van naftaleen:
C10H8 + 12 O2 → 10 CO2 + 4 H2O
isomerisatie
In een isomerisatiereactie wordt de structurele rangschikking van een verbinding veranderd, maar zijn netto atomaire samenstelling blijft hetzelfde.
Hydrolyse reactie
Een hydrolysereactie omvat water. De algemene vorm voor een hydrolysereactie is:
X-(aq) + H2O (l) ↔ HX (aq) + OH-(Aq)
De belangrijkste reactietypen
Er zijn honderden of zelfs duizenden soorten chemische reacties! Als u wordt gevraagd om de belangrijkste 4, 5 of 6 soorten chemische reacties te noemen, volgt u deze als volgt. De belangrijkste vier soorten reacties zijn directe combinatie, analysereactie, enkele verplaatsing en dubbele verplaatsing. Als je de vijf belangrijkste soorten reacties wordt gevraagd, zijn het deze vier en vervolgens zuur-base of redox (afhankelijk van wie je het vraagt). Houd er rekening mee dat een specifieke chemische reactie in meer dan één categorie kan vallen.
