Trans Isomer Definitie
 Share
Share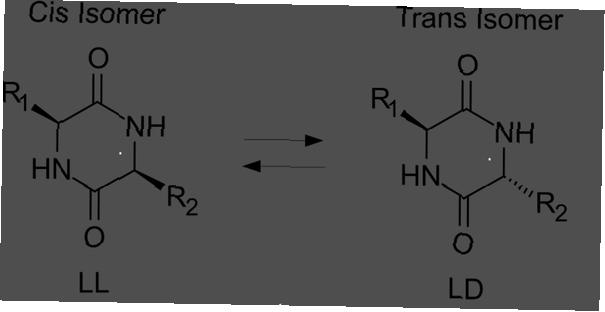
Een trans-isomeer is een isomeer waarbij de functionele groepen aan tegenovergestelde zijden van de dubbele binding verschijnen. Cis- en trans-isomeren worden vaak besproken met betrekking tot organische verbindingen, maar ze komen ook voor in anorganische coördinatiecomplexen en diazinen.
Trans-isomeren worden geïdentificeerd door toevoeging trans- aan de voorkant van de naam van het molecuul. Het woord trans komt van het Latijnse woord dat 'over' of 'aan de andere kant' betekent.
Voorbeeld: Het trans-isomeer van dichlooretheen wordt geschreven als trans-dichlooretheen.
Belangrijkste afhaalrestaurants: Trans Isomer
- Een trans-isomeer is er een waarin functionele groepen voorkomen aan tegenoverliggende zijden van een dubbele binding. In tegenstelling hiermee bevinden de functionele groepen zich aan dezelfde zijde als elkaar in een cis-isomeer.
- Cis- en trans-isomeren vertonen verschillende chemische en fysische eigenschappen.
- Cis en trans-isomeren delen dezelfde chemische formule, maar hebben een andere geometrie.
Cis en trans-isomeren vergelijken
Het andere type isomeer wordt een cis-isomeer genoemd. In cis-conformatie bevinden de functionele groepen zich beide aan dezelfde zijde van de dubbele binding (naast elkaar). Twee moleculen zijn isomeren als ze exact hetzelfde aantal en soorten atomen bevatten, alleen een andere rangschikking of rotatie rond een chemische binding. Moleculen zijn niet isomeren als ze een ander aantal atomen of verschillende soorten atomen van elkaar hebben.
Trans-isomeren verschillen van cis-isomeren in meer dan alleen uiterlijk. Fysieke eigenschappen worden ook beïnvloed door conformatie. Trans-isomeren hebben bijvoorbeeld de neiging om lagere smeltpunten en kookpunten te hebben dan overeenkomstige cis-isomeren. Ze hebben ook de neiging om minder dicht te zijn. Trans-isomeren zijn minder polair (meer niet-polair) dan cis-isomeren omdat de lading aan weerszijden van de dubbele binding in evenwicht is. Transalkanen zijn minder oplosbaar in inerte oplosmiddelen dan cis-alkanen. Transalkenen zijn meer symmetrisch dan cis alkenen.
Hoewel je misschien denkt dat functionele groepen vrij rond een chemische binding zouden roteren, dus een molecuul zou spontaan schakelen tussen cis- en trans-conformaties, dit is niet zo eenvoudig als het dubbele bindingen betreft. De organisatie van elektronen in een dubbele binding remt de rotatie, dus een isomeer heeft de neiging in een of andere conformatie te blijven. Het is mogelijk om de conformatie rond een dubbele binding te veranderen, maar dit vereist voldoende energie om de binding te verbreken en vervolgens te hervormen.
Stabiliteit van trans-isomeren
In acyclische systemen is het waarschijnlijker dat een verbinding een trans-isomeer vormt dan het cis-isomeer omdat deze gewoonlijk stabieler is. Dit komt omdat beide functiegroepen aan dezelfde zijde van een dubbele binding sterische hinder kunnen veroorzaken. Er zijn uitzonderingen op deze "regel", zoals 1,2-difluorethyleen, 1,2-difluorodiazeen (FN = NF), andere met halogeen gesubstitueerde ethylenen en sommige met zuurstof gesubstitueerde ethylenen. Wanneer de voorkeur wordt gegeven aan de cis-conformatie, wordt het fenomeen het "cis-effect" genoemd.
Contrasterende CIS en Trans met Syn en Anti
Rotatie is veel vrijer rond een enkele binding. Wanneer rotatie plaatsvindt rond een enkele binding, is de juiste terminologie syn (zoals cis) en anti (zoals trans) om de minder permanente configuratie aan te geven.
Cis / Trans vs E / Z
De cis- en trans-configuraties worden beschouwd als voorbeelden van geometrische isomerie of configuratie-isomerie. Cis en trans moeten niet worden verward met E/Z isomerie. E / Z is een absolute stereochemische beschrijving die alleen wordt gebruikt bij het verwijzen naar alkenen met dubbele bindingen die niet kunnen roteren of ringstructuren.
Geschiedenis
Friedrich Woehler merkte voor het eerst isomeren op in 1827 toen hij ontdekte dat zilvercyanaat en zilveren fulminaat dezelfde chemische samenstelling hebben, maar verschillende eigenschappen vertoonden. In 1828 ontdekte Woehler dat ureum en ammoniumcyanaat ook dezelfde samenstelling hadden, maar verschillende eigenschappen. Jöns Jacob Berzelius introduceerde de term isomerie in 1830. Het woord isomeer komt uit de Griekse taal en betekent "gelijk deel".
bronnen
- Eliel, Ernest L. en Samuel H. Wilen (1994). Stereochemie van organische verbindingen. Wiley Interscience. pp. 52-53.
- Kurzer, F. (2000). "Fulmininezuur in de geschiedenis van de organische chemie". J. Chem. Educ. 77 (7): 851-857. doi: 10,1021 / ed077p851
- Petrucci, Ralph H .; Harwood, William S .; Herring, F. Geoffrey (2002). Algemene chemie: principes en moderne toepassingen (8e editie). Upper Saddle River, N.J: Prentice Hall. p. 91. ISBN 978-0-13-014329-7.
- Smith, Janice Gorzynski (2010). Algemene, organische en biologische chemie (1e editie). McGraw-Hill. p. 450. ISBN 978-0-07-302657-2.
- Whitten K.W., Gailey K.D., Davis R.E. (1992). Algemene scheikunde (4e editie). Saunders College Publishing. p. 976-977. ISBN 978-0-03-072373-5.
