Definitie van de stand van zaken
 Share
Share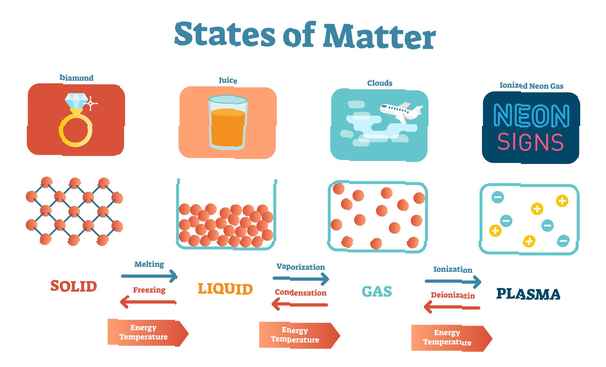
Natuurkunde en scheikunde bestuderen beide materie, energie en interacties daartussen. Uit de wetten van de thermodynamica weten wetenschappers dat materie van toestand kan veranderen en dat de som van de materie en energie van een systeem constant is. Wanneer energie aan materie wordt toegevoegd of verwijderd, verandert deze van status om een te vormen stand van zaken. Een toestand van materie wordt gedefinieerd als een van de manieren waarop materie met zichzelf kan samenwerken om een homogene fase te vormen.
Stand van zaken versus fase van materie
De uitdrukkingen "toestand van materie" en "fase van materie" worden door elkaar gebruikt. Voor het grootste deel is dit prima. Technisch gezien kan een systeem verschillende fasen van dezelfde materie bevatten. Een stalen staaf (een vaste stof) kan bijvoorbeeld ferriet, cementiet en austeniet bevatten. Een mengsel van olie en azijn (een vloeistof) bevat twee afzonderlijke vloeibare fasen.
Staten van Materie
In het dagelijks leven bestaan er vier fasen van materie: vaste stoffen, vloeistoffen, gassen en plasma. Er zijn echter verschillende andere materietoestanden ontdekt. Sommige van deze andere toestanden komen voor op de grens tussen twee toestanden van materie waar een substantie niet echt de eigenschappen van beide toestanden vertoont. Anderen zijn het meest exotisch. Dit is een lijst van enkele toestanden van materie en hun eigenschappen:
Solide: Een vaste stof heeft een gedefinieerde vorm en volume. Deeltjes in een vaste stof worden heel dicht bij elkaar verpakt, gefixeerd in een geordende indeling. De opstelling kan voldoende worden geordend om een kristal te vormen (bijvoorbeeld NaCl of keukenzoutkristal, kwarts) of de opstelling kan ongeordend of amorf zijn (bijvoorbeeld was, katoen, vensterglas).
Vloeistof: Een vloeistof heeft een gedefinieerd volume maar mist een gedefinieerde vorm. Deeltjes in een vloeistof zijn niet zo dicht bij elkaar gepakt als in een vaste stof, waardoor ze tegen elkaar kunnen glijden. Voorbeelden van vloeistoffen omvatten water, olie en alcohol.
Gas: Een gas mist een gedefinieerde vorm of volume. Gasdeeltjes zijn wijd gescheiden. Voorbeelden van gassen omvatten lucht en het helium in een ballon.
Plasma: Net als een gas heeft een plasma geen gedefinieerde vorm of volume. De deeltjes van een plasma zijn echter elektrisch geladen en worden gescheiden door grote verschillen. Voorbeelden van plasma zijn bliksem en de aurora.
Glas: Een glas is een amorfe vaste stof tussen een kristallijn rooster en een vloeistof. Het wordt soms als een afzonderlijke materietoestand beschouwd omdat het eigenschappen heeft die verschillen van vaste stoffen of vloeistoffen en omdat het in een metastabiele staat bestaat.
superfluid: Een superfluid is een tweede vloeibare toestand die bijna absoluut nul voorkomt. In tegenstelling tot een normale vloeistof heeft een superfluid nul viscositeit.
Bose-Einstein condensaat: Een Bose-Einstein-condensaat kan de vijfde toestand van materie worden genoemd. In een Bose-Einstein-condensaat gedragen de materiedeeltjes zich niet meer als individuele entiteiten en kunnen ze worden beschreven met een enkele golffunctie.
Fermionisch condensaat: Zoals een Bose-Einstein-condensaat, kunnen deeltjes in een fermionisch condensaat worden beschreven door één uniforme golffunctie. Het verschil is dat het condensaat wordt gevormd door fermionen. Vanwege het Pauli-uitsluitingsprincipe kunnen fermionen niet dezelfde kwantumtoestand delen, maar in dit geval gedragen paren fermionen zich als bosonen.
Dropleton: Dit is een "kwantummist" van elektronen en gaten die net als een vloeistof stromen.
Gedegenereerde Materie: Gedegenereerde materie is eigenlijk een verzameling exotische materiestoestanden die voorkomen onder extreem hoge druk (bijvoorbeeld in de kernen van sterren of massieve planeten zoals Jupiter). De term 'ontaard' komt voort uit de manier waarop materie in twee staten met dezelfde energie kan bestaan, waardoor ze uitwisselbaar zijn.
Zwaartekracht singulariteit: Een singulariteit, zoals in het midden van een zwart gat, is niet een toestand van materie. Het moet echter worden opgemerkt omdat het een 'object' is dat wordt gevormd door massa en energie zonder materie.
Faseveranderingen tussen toestanden van materie
Materie kan van toestand veranderen wanneer energie wordt toegevoegd of verwijderd uit het systeem. Gewoonlijk is deze energie het gevolg van veranderingen in druk of temperatuur. Wanneer materie verandert, ondergaat het een fase transitie of faseverandering.
