Peroxide definitie en feiten
 Share
Share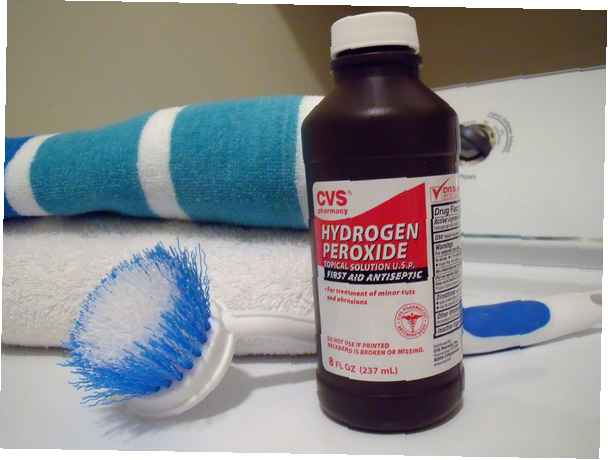
Een peroxide wordt gedefinieerd als een polyatomisch anion met moleculaire formule O22-. De verbindingen worden in het algemeen geclassificeerd als ionisch of covalent of organisch of anorganisch. De O-O-groep wordt de peroxogroep of peroxidegroep genoemd.
Peroxide verwijst ook naar elke verbinding die het peroxide-anion bevat.
Voorbeelden van peroxiden
- Waterstofperoxide, H2O2, is een eenvoudige peroxideverbinding.
- Andere anorganische peroxiden (behalve waterstofperoxide) zijn bekend. Deze worden geclassificeerd als ionische peroxiden of covalente peroxiden. Ionische peroxiden bevatten alkalimetaalionen of aardalkali-ionen als hun kationen. Covalente peroxiden omvatten waterstofperoxide en ook peroxymonosulfuurzuur (H2ZO5).
- Technisch gezien zijn superoxiden, ozonen, ozoniden en dioxygenylen peroxideverbindingen, maar ze worden vaak als apart beschouwd vanwege hun speciale eigenschappen.
Voorkomen en gebruik van peroxide
- Peroxiden komen van nature in kleine hoeveelheden voor in planten en dieren, water en de atmosfeer. Bij mensen en andere dieren is waterstofperoxide een bijproduct van biochemische reacties. De chemische stof heeft een korte levensduur, maar is giftig voor cellen vanwege het vermogen om DNA, eiwitten en membraanlipiden te oxideren. Deze toxiciteit maakt peroxide nuttig als ontsmettingsmiddel, om bacteriën en andere ziekteverwekkers te doden. Bijna alle eukaryotische cellen vormen echter opzettelijk peroxide in organellen die peroxisomen worden genoemd. Peroxisomen worden gebruikt voor katabolisme van vetzuren, D-aminozuren en polyaminen en voor biosynthese van verbindingen die essentieel zijn voor een normale long- en hersenfunctie.
- Het enzym catalase gebruikt peroxide om substraten te oxideren om toxines in de nier- en levercellen te neutraliseren. Op deze manier kunnen mensen bijvoorbeeld ethanol metaboliseren tot acetaldehyde.
- Planten gebruiken waterstofperoxide als een signaalstof die de verdediging tegen ziekteverwekkers aangeeft.
- Sommige peroxiden kunnen organische moleculen bleken of ontkleuren, zodat ze worden toegevoegd aan reinigingsmiddelen en haarkleurmiddelen.
- Peroxiden worden veel gebruikt om medicijnen en andere chemicaliën te synthetiseren.
- De bombardierkever slaat hydrochinon en waterstofperoxide op in buikreservoirs. Wanneer de kever wordt bedreigd, mengt hij de chemicaliën met elkaar, wat resulteert in een exotherme reactie waardoor de kever kokend hete, stinkende vloeistof bij een bedreiging spuit..
Peroxide veilig hanteren
De meeste mensen zijn bekend met huishoudelijke waterstofperoxide-oplossingen, een verdunde oplossing van waterstofperoxide in water. Het type peroxide dat wordt verkocht voor desinfectie en reiniging is ongeveer 3% peroxide in water. Wanneer gebruikt om haar te bleken, wordt deze concentratie V10 genoemd. Hogere concentraties kunnen worden gebruikt om haar te bleken of voor industriële reiniging. Terwijl 3% huishoudelijk peroxide een veilige chemische stof is, is geconcentreerd peroxide uiterst gevaarlijk!
Peroxiden zijn krachtige oxidatiemiddelen die ernstige chemische brandwonden kunnen veroorzaken.
Bepaalde organische peroxiden, zoals TATP (triaceton-triperoxide)) en HMTD (hexamethyleentriperoxidediamine), zijn zeer explosief. Het is belangrijk om te begrijpen dat deze zeer onstabiele verbindingen per ongeluk kunnen worden gemaakt door aceton of andere ketonoplosmiddelen te mengen met waterstofperoxide. Om deze en om andere redenen is het onverstandig om peroxiden te mengen met andere chemicaliën, tenzij je volledige kennis hebt van de resulterende reactie.
Peroxideverbindingen moeten worden bewaard in ondoorzichtige containers, op koele, trillingsvrije locaties. Warmte en licht versnellen chemische reacties met peroxiden en moeten worden vermeden.
