Wat zijn de elementen in het menselijk lichaam?
 Share
Share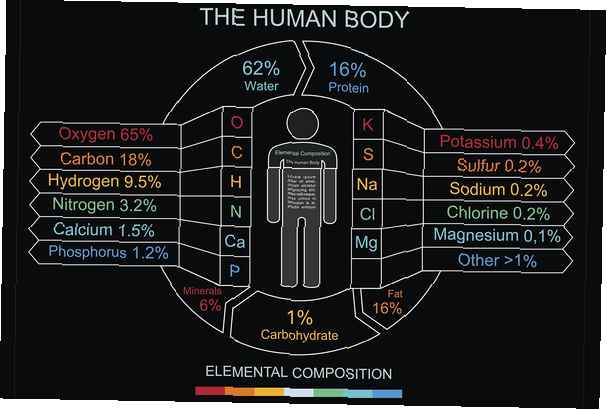
Er zijn verschillende manieren om de samenstelling van het menselijk lichaam te overwegen, inclusief de elementen, het type molecuul of het type cellen. Het grootste deel van het menselijk lichaam bestaat uit water, H2O, met cellen bestaande uit 65-90 gew.% Water. Daarom is het niet verwonderlijk dat het grootste deel van de massa van een menselijk lichaam zuurstof is. Koolstof, de basiseenheid voor organische moleculen, komt op de tweede plaats. 99% van de massa van het menselijk lichaam bestaat uit slechts zes elementen: zuurstof, koolstof, waterstof, stikstof, calcium en fosfor.
- Zuurstof (O) - 65% - Zuurstof vormt samen met waterstof water, het primaire oplosmiddel dat in het lichaam wordt aangetroffen en wordt gebruikt om de temperatuur en osmotische druk te reguleren. Zuurstof komt voor in veel belangrijke organische verbindingen.
- Koolstof (C) - 18% - Koolstof heeft vier bindingsplaatsen voor andere atomen, waardoor het het belangrijkste atoom is voor organische chemie. Koolstofketens worden gebruikt om koolhydraten, vetten, nucleïnezuren en eiwitten te bouwen. Bindingen verbreken met koolstof is een energiebron.
- Waterstof (H) - 10% - Waterstof komt voor in water en in alle organische moleculen.
- Stikstof (N) - 3% - Stikstof wordt gevonden in eiwitten en in de nucleïnezuren waaruit de genetische code bestaat.
- Calcium (Ca) - 1,5% - Calcium is het meest voorkomende mineraal in het lichaam. Het wordt gebruikt als structureel materiaal in botten, maar het is essentieel voor eiwitregulatie en spiercontractie.
- Fosfor (P) - 1,0% - Fosfor wordt aangetroffen in het molecuul ATP, de primaire energiedrager in cellen. Het wordt ook in bot gevonden.
- Kalium (K) - 0,35% - Kalium is een belangrijke elektrolyt. Het wordt gebruikt om zenuwimpulsen en hartslagregulatie over te brengen.
- Zwavel (S) - 0,25% - Twee aminozuren omvatten zwavel. De bindingszwavelvormen helpen eiwitten de vorm te geven die ze nodig hebben om hun functies uit te voeren.
- Natrium (Na) - 0,15% - Natrium is een belangrijke elektrolyt. Net als kalium wordt het gebruikt voor zenuwsignalering. Natrium is een van de elektrolyten die helpt de hoeveelheid water in het lichaam te reguleren.
- Chloor (Cl) - 0,15% - Chloor is een belangrijk negatief geladen ion (anion) dat wordt gebruikt om de vloeistofbalans te handhaven.
- Magnesium (Mg) - 0,05% - Magnesium is betrokken bij meer dan 300 metabole reacties. Het wordt gebruikt om de structuur van spieren en botten op te bouwen en is een belangrijke cofactor voor enzymatische reacties.
- Ijzer (Fe) - 0,006% - IJzer wordt gevonden in hemoglobine, het molecuul dat verantwoordelijk is voor zuurstoftransport in rode bloedcellen.
- Koper (Cu), Zink (Zn), Selenium (Se), Molybdeen (Mo), Fluor (F), Jodium (I), Mangaan (Mn), Kobalt (Co) - totaal minder dan 0,70%
- Lithium (Li), Strontium (Sr), Aluminium (Al), Silicium (Si), Lood (Pb), Vanadium (V), Arseen (As), Broom (Br) - aanwezig in sporenhoeveelheden
Vele andere elementen kunnen in extreem kleine hoeveelheden worden gevonden. Het menselijk lichaam bevat bijvoorbeeld vaak sporen van thorium, uranium, samarium, wolfraam, beryllium en radium. Spoorelementen die als essentieel worden beschouwd bij mensen zijn zink, jodium, mogelijk silicium, waarschijnlijk boor, selenium, waarschijnlijk nikkel, chroom, mangaan, lithium, mogelijk arseen, molybdeen, kobalt en mogelijk vanadium.
Niet alle elementen in het lichaam zijn essentieel voor het leven. Sommige worden beschouwd als verontreinigende stoffen die geen kwaad lijken te doen, maar geen bekende functie hebben. Voorbeelden hiervan zijn cesium en titanium. Anderen zijn actief giftig, waaronder kwik, cadmium en de radioactieve elementen. Arseen wordt als giftig voor de mens beschouwd, maar dient in andere hoeveelheden een functie bij andere zoogdieren (geiten, ratten, hamsters). Aluminium is interessant omdat het het derde meest voorkomende element in de aardkorst is, maar toch geen bekende functie heeft in levende cellen. Hoewel fluor door planten wordt gebruikt om beschermende toxines te produceren, heeft het geen essentiële biologische rol in de mens.
Misschien wilt u ook de elementaire samenstelling van een gemiddeld menselijk lichaam per massa bekijken.
bronnen
- Chang, Raymond (2007). Chemie, 9e editie. McGraw-Hill. ISBN 0-07-110595-6.
- Emsley, John (2011). De bouwstenen van de natuur: een AZ-gids voor de elementen. OUP Oxford. p. 83. ISBN 978-0-19-960563-7.
- Frausto Da Silva, J. J. R; Williams, R. J. P (16-08-2001). De biologische chemie van de elementen: de anorganische chemie van het leven. ISBN 9780198508489.
- H. A., V. W. Rodwell; P. A. Mayes, Overzicht van Fysiologische Chemie, 16e ed., Lange Medical Publications, Los Altos, Californië 1977.
- Zumdahl, Steven S. en Susan A. (2000). Chemie, 5e editie. Houghton Mifflin Company. p. 894. ISBN 0-395-98581-1.
