Definitie en voorbeelden van niet-polaire moleculen
 Share
Share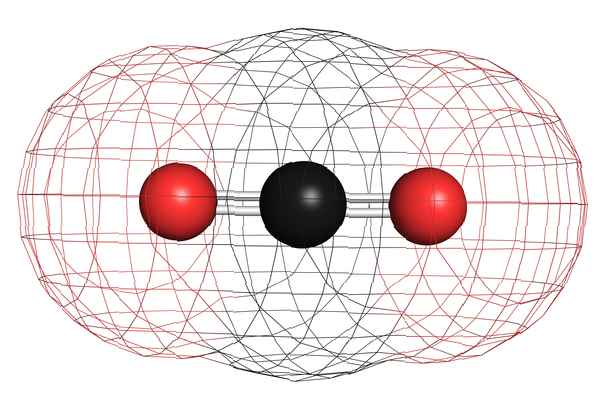
Een niet-polair molecuul heeft geen scheiding van lading, dus er worden geen positieve of negatieve polen gevormd. Met andere woorden, de elektrische ladingen van niet-polaire moleculen zijn gelijkmatig over het molecuul verdeeld. Niet-polaire moleculen hebben de neiging goed op te lossen in niet-polaire oplosmiddelen, die vaak organische oplosmiddelen zijn.
In een polair molecuul heeft één zijde van het molecuul een positieve elektrische lading en heeft de andere zijde een negatieve elektrische lading. Polaire moleculen lossen meestal goed op in water en andere polaire oplosmiddelen.
Er zijn ook amfifiele moleculen, grote moleculen waaraan zowel polaire als niet-polaire groepen zijn bevestigd. Omdat deze moleculen zowel polair als niet-polair karakter hebben, vormen ze goede oppervlakteactieve stoffen, die helpen bij het mengen van water met vetten.
Technisch gezien bestaan de enige volledig niet-polaire moleculen uit een enkel type atoom of uit verschillende soorten atomen die een bepaalde ruimtelijke ordening vertonen. Veel moleculen zijn intermediair, niet volledig niet-polair of polair.
Wat bepaalt de polariteit?
Je kunt voorspellen of een molecuul polair of niet-polair zal zijn door te kijken naar het type chemische bindingen gevormd tussen de atomen van de elementen. Als er een significant verschil is tussen de elektronegativiteitswaarden van de atomen, worden de elektronen niet gelijk verdeeld tussen de atomen. Met andere woorden, de elektronen zullen meer tijd dichter bij het ene atoom doorbrengen dan het andere. Het atoom dat aantrekkelijker is voor het elektron zal een schijnbare negatieve lading hebben, terwijl het atoom dat minder elektronegatief is (meer elektropositief) een netto positieve lading zal hebben.
Het voorspellen van de polariteit wordt vereenvoudigd door de puntgroep van het molecuul te overwegen. Kortom, als de dipoolmomenten van een molecuul elkaar opheffen, is het molecuul niet-polair. Als de dipoolmomenten niet worden opgeheven, is het molecuul polair. Niet alle moleculen hebben een dipoolmoment. Een molecuul met een spiegelvlak heeft bijvoorbeeld geen dipoolmoment omdat de afzonderlijke dipoolmomenten niet in meer dan één dimensie (een punt) kunnen liggen.
Niet-polaire molecuulvoorbeelden
Voorbeelden van homonucleaire niet-polaire moleculen zijn zuurstof (O2), stikstof (N2) en ozon (O3). Andere niet-polaire moleculen omvatten koolstofdioxide (CO2) en de organische moleculen methaan (CH4), tolueen en benzine. De meeste koolstofverbindingen zijn niet-polair. Een opmerkelijke uitzondering is koolmonoxide, CO. Koolmonoxide is een lineair molecuul, maar het verschil in elektronegativiteit tussen koolstof en zuurstof is groot genoeg om het molecuul polair te maken.
Alkynen worden beschouwd als niet-polaire moleculen omdat ze niet in water oplossen.
De edele of inerte gassen worden ook als niet-polair beschouwd. Deze gassen bestaan uit afzonderlijke atomen van hun element, zoals argon, helium, krypton en neon.
